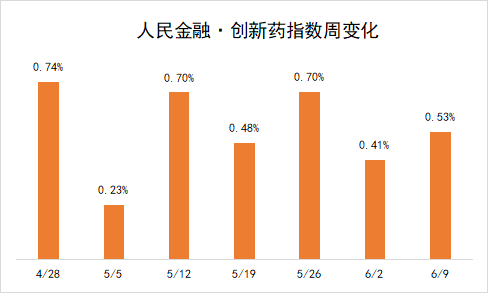
人民金融·创新药指数涨0.53%ASCO年会ADC成焦点国产ADC药物繁
在刚刚结束的2022 ASCO年会上,ADC技术备受瞩目,明星药物恩赫图再次大放异彩,国内ADC也公布了靓丽的研究数据目前国内企业研发ADC药物的热情空前高涨,传统制药巨头和生物技术公司纷纷布局但热闹的背后,是国内ADC药物严重的同质化研发,在研品种主要是第一代药物的me—too面对顶级showstopper的入侵,会有不小的挑战
在6月3日至6月9日的新发布周期中,信达生物和驯鹿医疗合作的Ikirensai注射剂的上市申请被接受这是首个针对BCMA的CAR—T疗法,已宣布在中国上市,同时,来自何频药业,银嘉宝药业,君实生物等7个创新药物项目首次在临床上获得批准,我们将其纳入人民金融创新药物指数目前民财创新药指数共有1437个成分样本
在这些因素的推动下,人民金融与创新药指数在新发布周期上涨0.53%,最新报2699.81点。
一年一度的ASCO年会是全球制药公司展示实力的时候在刚刚结束的2022年ASCO年会上,数据最亮的非抗体偶联药物是唯一的
其中,由第一第三共和国和阿斯利康联合开发的恩赫图备受关注在这次ASCO上,Enhertu宣布了针对HER2低表达患者的3期试验,结果呈阳性,这是一个真正的突破
第一第三共和国和阿斯利康报道的DESTINY—Breast 04研究结果显示,与化疗方案相比,Enhertu使HR阳性,HER2低表达的转移性乳腺癌患者的疾病进展或死亡风险降低49%,在所有接受评估的患者中,与化疗相比,Enhertu延长了患者的中位总生存期超过6个月。
这意味着Enhertu成为第一个被证明能为HER2低表达患者带来生存益处的HER2靶向治疗基于此,业界期待恩赫图重塑HER2低表达乳腺癌的治疗模式,甚至改写疾病分类标准
同样在本次ASCO上,国内ADC先驱荣昌生物,乐普生物,科伦药业也公布了其ADC产品的最新研究成果。
其中荣昌生物的virtuximab带来了尿路上皮癌的三项临床数据,在HER2乳腺癌竞争激烈的当下,开拓了尿路上皮癌的蓝海市场或许与ASCO公布的数据有关,荣昌生物a股股价近期强势反弹,6月以来累计涨幅超过40%,领涨当地上市创新型医药公司
ADC,即抗体偶联药物,是一种由抗体,毒素和接头组成的创新药物,能准确地将毒素输送到肿瘤细胞,从而起到杀伤作用,因此被称为生物导弹。
最近几年来,ADC技术已成为全球抗肿瘤药物技术的研发热点据统计,目前全球已有13种ADC药物获批上市,临床活跃药物超过100种根据NatureReviewsDrugDiscovery发表的分析,预计2026年全球ADC药物市场规模将达到164亿美元
面对这样一个前景广阔的市场,国内企业的R&D热情也空前高涨,传统医药巨头和生物技术公司纷纷布局走在前列的荣昌生物,科伦药业,乐普生物正在奋起直追从去年开始,天士力,华东制药,珍宝岛等传统药企也跨界进入ADC今年,济世药业,复旦张江等创新型药企也迎来了首批获批临床或IND受理的ADC药物
可是,热闹的背后,越来越拥挤的目标给ADC药物的市场前景蒙上了一层阴影。
据我们不完全统计,目前国内处于临床阶段或IND接受阶段的ADC药物超过60种,其中约40%以HER2为靶点,约12%以TROP2为靶点显然,这种目标赛道已经人满为患,产品上市后将面临残酷的竞争格局
同时,在研的ADC项目也面临着技术迭代的风险很多项目虽然处于临床早期,但实际上已经成为前浪中信证券研报数据显示,截至2021年底,国内在研HER2 ADC多达22个,在研ADC药物多以第一代ADC药物enmetruzumab为基础,目标是成为enmetruzumab的me—too或me—better产品
此外,国内ADC领域即将上演狼来了的故事有ADC领域天花板之称的恩赫图,今年3月提交国内上市申请,5月被列入优先审查对象,这意味着国内ADC企业从2023年开始将面临全球顶级ADC产品的竞争如何在恩赫图的攻势下突围,将成为国内企业的一大挑战
中国首款BCMA汽车上市。
最近几天,信达生物与驯鹿医疗合作的Ikirensai注射液上市申请被CDE受理,拟纳入优先审评审批适应症为既往三线或以上全身治疗后复发或难治性多发性骨髓瘤的成年患者这是首个针对BCMA的CAR—T疗法,已在中国申报上市
据信达生物关伟公司介绍,伊吉仁赛注射液由信达生物和驯鹿生物共同研发,于2021年2月被国家医药产品管理局药物评价中心授予突破性治疗药物。
NDA的提交是基于一项关于伊卡伦西注射液的1/2期注册临床研究的结果去年12月,信达生物驯鹿医疗在2021年美国血液学学会第63届年会上报告了这项注册临床研究的结果研究数据显示伊基仁赛注射液具有优异的安全性和有效性,ORR为94.9%,完全缓解/严格完全缓解为58.2%
信达表示,正在积极进行伊卡仑西注射液的海外发展和布局2022年2月,Ikirensai注射液被美国美国食品药品监督管理局认定为孤儿药,用于治疗复发/难治性多发性骨髓瘤同时,Ikirensai注射液的适应症也在扩大上个月,新的抗体介导的视神经脊髓炎注射液的临床试验申请被国家医疗产品管理局接受
值得一提的是,今年2月底,联想生物在美国的上市申请获得FDA批准,成为中国第一个获得FDA批准的细胞治疗产品,也是全球第二个获批的针对BCMA的CAR—T细胞免疫疗法目前,在中国,还没有针对BCMA的CAR—T疗法被批准上市Ikironset的报道早于Cedar Kinoset,有望成为中国批准的首个BCMA靶向CAR—T疗法
7个创新药物项目首次获得临床批准。
在新的发布周期中,来自河博药业,嘉宝药业银,君实生物等7个创新药物项目获得临床批准,包括四种生物药物和三种化学药物我们将其纳入人民金融创新药物指数目前民财创新药指数共有1437个成分样本
其中,嘉和生物的注射用GB263T于6月8日获得临床批准,适应症为晚期非小细胞肺癌等实体瘤根据介绍,GB263T是世界上第一个EGFR/cMET/cMET三特异性抗体,针对EGFR和两个不同的cMET表位体外研究和体内动物模型证明了其显著的抗肿瘤活性日前,GB263T在澳大利亚第一次人体临床试验中给第一位患者服用
以及铂药申报的注射用HBM7008,6月7日临床获批,拟适应症为晚期实体瘤公开资料显示,HBM7008是铂药研发的首个双特异性抗体,同时针对肿瘤抗原B7H4和4—1BB最近,该药物已在澳大利亚的1期临床试验中用于第一名患者
已获得君实生物临床批准的JS116胶囊是KRAS G12C的小分子抑制剂,将开展KRAS G12C突变晚期实体瘤临床试验君生物表示,KRAS基因突变有不同的亚型,其中KRAS G12C占所有KRAS突变的44%,在非小细胞肺癌中最常见临床前研究表明,JS116具有较宽的安全窗口,良好的有效性和安全性,有望成为一种安全高效的精准靶向治疗药物目前国际上只有针对KRASG12C的靶向药物Lumakras获准上市,国内还没有KRAS G12C的小分子抑制剂获准上市
声明:本网转发此文章,旨在为读者提供更多信息资讯,所涉内容不构成投资、消费建议。文章事实如有疑问,请与有关方核实,文章观点非本网观点,仅供读者参考。
- 360发放百亿补贴支持中小企业数字化转型,并推出免费Saas产品“企业安 今日,360创始人周宣布,360将发放数百亿补贴支持中小企业数字化转型同时,中国中小企业协会与360宣布达成战略合作,双...
- Thimax膳美师与你携手 共同创造品质生活 古往今来,美食一直是在人类社会中经久不衰的问题。但是世界上的美食可谓是丰富多彩,如何烹制出一道美食成为当下人们的追求。一...
- 斯莱克拟定增募不超8.37亿获深交所通过安信证券建功 昨晚,斯莱克发布了《关于苏州斯莱克精密设备股份有限公司向特定对象发行股份申请审核中心意见的执行函》根据《证券法》,《创业...
- 湖南多措并举稳消费商贸流通企业有信心 最近几天,国务院办公厅印发《关于进一步释放消费潜力促进消费可持续回升的意见》湖南也出台了《关于进一步释放消费潜力促进消费...
- 兴业银行601166.SH涨2.4%银行ETF基金512700.SH份额 日前,午后两市震荡走弱,银行板块逆市上涨截至13:30,权重股兴业银行涨2.4%,银行ETF基金上涨1.04%在稳增长政...
- 广东茂名石化化工分部球罐泵泄漏引发火情目前2人失联1人受伤 据广东茂名应急管理局6月9日通报,6月8日12时45分左右,茂名石化化工分公司一球罐泵发生泄漏,引发火灾茂名立即启动应急...
- 吃菜也能减碳了首批零碳认证有机蔬菜上架盒马门店 日前,全国首批零碳认证有机蔬菜在盒马全国门店上线在这些蔬菜袋上,有一个绿色的圆形标识——标着零碳农产品,表示这袋蔬菜在生...
- 2022年度“沪惠保”正式开放参保已有超370万人预约投保 2022年6月9日上午10点,上海包惠上线启动云发布据介绍,自5月25日慧保开通预约保险以来,截至目前,本市已有370多...
- 首贷破冰!小微企业搭上“5G快车” 陕西巨人商务信息咨询成立于2008年,主要从事国内通信运营商部分基站建设和日常维护的设备供应最近几年来,伴随着互联网的快...
- 苹果发布新的AirPodsBeta开发者测试版固件,配对设备需升级iOS ,继本周早些时候发布iOS16和macOS13的第一个测试版之后,苹果现在已经向开发者发布了新的AirPods测试版固件...
- 尚未开售立打85折:索尼WH-1000XM5降噪耳机6期免息 索尼WH—1000XM5旗舰耳机国行版5月预售,售价2999元,6月14日正式上市。 6期免息支持期,每期仅需424....
- Thimax膳美师│水光煲绝对“煲你满意”,送你一碗打了水光针的米饭! 随着人们生活水平的不断提高,对生活品质也提出了更高的要求。就拿大米来讲,作为我们日常生活中不可或缺的主食,越来越多的朋友...
- 官宣:上汽通用五菱大疆联合造车 据五菱汽车官微消息,上汽通用五菱与DJI正式宣布,双方首次全球战略合作正式落地,全球首款搭载DJI车辆系统的新能源量产车...
- 广西武宣中奖者独揽1066万元 日前,福彩双色球第2022064期开奖,开奖号码为040612131731+16当期开出12注一等奖,单注奖金649万元...
- SensorTower:5月抖音及海外版TikTok蝉联全球移动应用非游 根据SensorTowerstore的情报数据,2022年5月,TikTok抖音及海外版在全球AppStore和Goog...
热门资讯
-
 28分钟送药到家,叮当健康再递交上市
最新招股书显示,2019年、2020...
28分钟送药到家,叮当健康再递交上市
最新招股书显示,2019年、2020...
-
 浙商证券:为何不能再用盈利来预测制造
能源变革下盈利与制造业投资的关联性较...
浙商证券:为何不能再用盈利来预测制造
能源变革下盈利与制造业投资的关联性较...
-
 中国太保紧急启动抗疫应急预案!确保“
3月28日是上海在全市范围内开展新一...
中国太保紧急启动抗疫应急预案!确保“
3月28日是上海在全市范围内开展新一...
-
 币安美国计划在3年内进行IPO,其四
图片来源:视觉中国3月28日,据Fo...
币安美国计划在3年内进行IPO,其四
图片来源:视觉中国3月28日,据Fo...
-
 茅台提前披露业绩:2021年总营收1
出品丨搜狐财经作者丨李文贤3月28日...
茅台提前披露业绩:2021年总营收1
出品丨搜狐财经作者丨李文贤3月28日...
-
 邮储银行发布新市民专属“U+卡”助推
3月28日,中国邮政储蓄银行举办新市...
邮储银行发布新市民专属“U+卡”助推
3月28日,中国邮政储蓄银行举办新市...
-
 华为去年营收6368亿净利润1137
华为昨日举行2021年年度报告发布会...
华为去年营收6368亿净利润1137
华为昨日举行2021年年度报告发布会...
-
 迪马股份:港交所已审议旗下物业公司东
3月28日,重庆市迪马实业股份有限公...
迪马股份:港交所已审议旗下物业公司东
3月28日,重庆市迪马实业股份有限公...
文章排行
图片新闻
-
 公告精选:奥泰生物等一季度业绩大幅预
3月28日晚间公告精选:西麦食品将于...
公告精选:奥泰生物等一季度业绩大幅预
3月28日晚间公告精选:西麦食品将于...
-
 开车省,养车更省,性价比之王优选奕炫
近期油价上涨,不少人把目光投向了新能...
开车省,养车更省,性价比之王优选奕炫
近期油价上涨,不少人把目光投向了新能...
-
 汉王科技:公司控股子公司汉王鹏泰目前
每经AI快讯,有投资者在投资者互动平...
汉王科技:公司控股子公司汉王鹏泰目前
每经AI快讯,有投资者在投资者互动平...
-
 平煤股份:2021年净利同比增110
平煤股份3月28日晚间披露年报,20...
平煤股份:2021年净利同比增110
平煤股份3月28日晚间披露年报,20...
-
 阳光城:未能按照约定筹措足额偿付“1
阳光城28日晚间发布公告称,因受宏观...
阳光城:未能按照约定筹措足额偿付“1
阳光城28日晚间发布公告称,因受宏观...
-
 胜蓝股份:发行可转债3.30亿元申购
胜蓝股份3月28日晚间发布公告称,胜...
胜蓝股份:发行可转债3.30亿元申购
胜蓝股份3月28日晚间发布公告称,胜...
-
 新冠检测订单增长奥泰生物一季度业绩预
3月28日晚间,奥泰生物公布了202...
新冠检测订单增长奥泰生物一季度业绩预
3月28日晚间,奥泰生物公布了202...
-
 增程技术成热门,2022中国电动汽车
3月25日-27日,“2022中国电...
增程技术成热门,2022中国电动汽车
3月25日-27日,“2022中国电...